Bakterier kan overleve stress
De fleste bakterier kan overleve i naturen under ekstreme forhold, selv når de mangler næring eller angribes af omgivelserne. Bakterier har blandt andet udviklet en mekanisme, hvor de kan gå i en slags dvale-tilstand, fx hvis de angribes af antibiotika – og så er de modstandsdygtige overfor næsten alt. Forskere fra Biologisk Institut har nu afsløret, hvordan bakterierne går i dvale-tilstand , hvilket er et vigtigt skridt for større forståelse af antibiotika-tolerans.
Når Salmonella bakterier inficerer et menneske vil bakteriecellerne kunne findes inde i kroppens immunceller, -nærmere de såkaldte makrofager, som kroppen bruger til at bekæmpe infektioner med (bakterier og vira). Der foregår således en ”kamp” mellem makrofagen og bakterien: makrofagen bombarderer bakterien med giftige oxygen-forbindelser og forårsager lav pH og aminosyre-mangel ved at indkapsle bakterien i særlige steder i cellen (vakuoler). Disse angreb udløser bakteriens forsvarsmekanisme, det såkaldte stringent-respons, som er en overlevelses-mekanisme, der ændrer bakteriens stofskifte fra hurtig vækst til langsom vækst eller dvale. Den langsomme vækst gør, at bakterierne bliver meget mere modstandsdygtige over for makrofagens angreb, - og også over for antibiotika.
Bakterier kan skrue op og ned for deres vækstrate
- ’Det har været kendt i mange år, at det bakterielle stringent-respons er nødvendigt for at Escherichia coli, Salmonella, Pseudomonas og Mycobacterium tuberculosis og langt de fleste andre sygdomsfremkaldende bakterier kan forårsage infektion og sygdom ved mennesker og dyr, forklarer professor Kenn Gerdes fra BASP centret, Biologisk Institut, Københavns Universitet.
Imidlertid har den molekylære mekanisme, der aktiverer bakteriens stringent-respons været ukendt,, men nu har forskergruppen opnået et vigtigt fremskridt med hensyn til den generelle forståelse af, hvorledes bakterierne aktiverer deres stringent-respons. Resultaterne er netop offentliggjort i forskningstidssskriftet Molecular Cell.
- Kenn Gerdes forklarer, ’De fleste bakterier har et enzym kaldet Rel, der danner et signal-molekyle (kaldet et ’alarmon’) i cellen, som fortæller bakterien, at nu er der ”fare på færde”. Det er dette ’alarmon’, der ændrer bakteriens stofskifte til en stress-resistent tilstand: bakterien nedsætter væksthastigheden og begynder samtidigt at nedbryde dele af cellens naturlige komponenter og frigiver derved byggesten, som bakterien selv har brug for’.
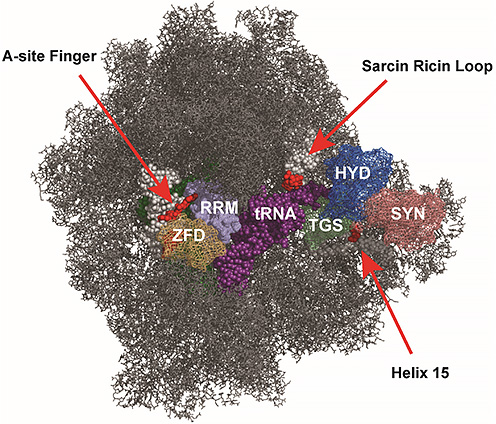 Rel protein i kompleks med uladet tRNA og det bakterielle ribosom (vist i gråt). SYN, HYD, TGS, ZDF og RRM er evolutionært bevarede domæner i Rel proteiner. Domænerne ZFD (Zink-finger domæne) og RRM (RNA genkendelsesmotiv) binder til en RNA struktur i ribosomet kaldet A-site finger, medens TGS (Threonin, GTPase og SpoT) domænet genkender og binder til uladet tRNA (dvs. tRNA, der mangler en aminosyre-rest. Uladet tRNA er farvet violet. Samtidigt interagerer TGS domænet også med ribosomets Helix 15. Herved bindes Rel stabilt til ribosomet, der er standset på grund af mangel på aminosyrer. Krydsbinding mellem Rel og Sarcin-Ricin Loop (SRL) blev også opdaget i dette studie. SRL er universelt bevaret i alle levende organismer, og befinder sig i nærheden af HYD og SYN domænerne når Rel er bundet til ribosomet og kan potentielt virke som en kontakt, der aktiverer Rel. Områder i A-site Finger, Helix 15 og SRL hvor der blev vist kontakt mellem Rel og ribosomet er vist med rødt. Strukturen er adapteret fra DOI: 10.2210/pdb5IQR/pdb
Rel protein i kompleks med uladet tRNA og det bakterielle ribosom (vist i gråt). SYN, HYD, TGS, ZDF og RRM er evolutionært bevarede domæner i Rel proteiner. Domænerne ZFD (Zink-finger domæne) og RRM (RNA genkendelsesmotiv) binder til en RNA struktur i ribosomet kaldet A-site finger, medens TGS (Threonin, GTPase og SpoT) domænet genkender og binder til uladet tRNA (dvs. tRNA, der mangler en aminosyre-rest. Uladet tRNA er farvet violet. Samtidigt interagerer TGS domænet også med ribosomets Helix 15. Herved bindes Rel stabilt til ribosomet, der er standset på grund af mangel på aminosyrer. Krydsbinding mellem Rel og Sarcin-Ricin Loop (SRL) blev også opdaget i dette studie. SRL er universelt bevaret i alle levende organismer, og befinder sig i nærheden af HYD og SYN domænerne når Rel er bundet til ribosomet og kan potentielt virke som en kontakt, der aktiverer Rel. Områder i A-site Finger, Helix 15 og SRL hvor der blev vist kontakt mellem Rel og ribosomet er vist med rødt. Strukturen er adapteret fra DOI: 10.2210/pdb5IQR/pdb
Et komplekst system undersøges
Det har hidtil været ukendt, hvor Rel enzymet aktiveres til at syntetisere alarmonet. Ved brug af en ny molekylærbiologisk metode kaldet CRAC har forskerne fra Biologisk Institut, Kristoffer Winther, Mohammad Roghanian og Kenn Gerdes, belyst dette fænomen.
- ’Rel er et meget kompliceret enzym, og når bakterien vokser hurtigt (dvs. uden påvirkning af stress), findes Rel-enzymet frit i bakterie-cellen. Med denne nye CRAC metode har vi vist, at når cellen mangler visse byggestene i form af forskellige aminosyrer, så bindes Rel enzymet stabilt til ribosomerne, som er bakteriecellens proteinsyntese ”maskiner” (vist i boksen 'Yderligere info' herover).
De nye observationer er bemærkelsesværdige, fordi man nu ved med stor nøjagtighed har været i stand til at vise, hvor Rel enzymet binder i cellen, henholdsvis når bakterien vokser under normale forhold eller er påvirket af forskellige stressfaktorer.
Disse bindingssteder – og hvilke faktorer der skal gøre sig gældende for, at Rel enzymet kan ændre aktivitetsmønster fra inaktiv til aktiv tilstand, giver en meget dybere forståelse for, hvordan bakterier formår at overleve under fjendtlige betingelser. Og det er en helt afgørende viden, hvis man skal kunne sætte mere målrettet ind i kampen mod resistente bakterier.
Kontakt
Professor Kenn Gerdes
Biologisk Institut, Københavns Universitet
Tlf. 5182 7057
Mail: kgerdes@bio.ku.dk
Helle Blæsild
Kommunikation & Presse
Biologisk Institut, Københavns Universitet
Tlf. 2875 2076
Mail: kommunikation@bio.ku.dk
Forskningsartikel
Artikel i Molecular Cell
https://www.cell.com/molecular-cell/fulltext/S1097-2765(18)30178-3
