Livets ulidelige kompleksitet
I den molekylære verden har man altid set livets grundbestanddele som sammensatte og indviklede at gennemskue, men indtil nu har man i strukturbiologien dog arbejdet inden for en vis orden i kaosset. Et protein har kun haft en funktion, når struktur og form var tilstede. Den orden er slut nu.
Form og struktur har altid været grundlaget for interaktion og kommunikation mellem proteiner, gener og celler. Proteiner har formet en helt specifik struktur, og molekylerne har dannet par, hvor den ene part har fungeret som en ’lås, der krævede en specifik nøgle for at åbne’. Et forskningsteam bestående af forskere fra Københavns Universitet, Zürich Universitet, og NIH, USA, har nu opdaget et overraskende fænomen i molekylær kommunikation, og resultaterne er netop offentliggjorte i tidsskriftet Nature.
- ’Vi har som de første vist, at to proteiner helt uden brug af form og flader, kan danne et utroligt stærkt kompleks, der bevares i en fuldt dynamisk tilstand. Proteinerne har høj, modsatrettet ladning, og netop dette er afgørende. Disse to proteiners kommunikation er vigtig for læsningen af vores DNA’, siger professor Birthe B. Kragelund fra Biologisk Institut, Københavns Universitet.
Forskningen viser også, at der er mange andre proteiner i det menneskelige proteom, der potentielt kan indgå i lignende komplekser. Det åbner pludselig op for helt enorme muligheder for proteinsammensætninger og funktioner, som man ikke troede muligt. Og selvom fænomenet, der giver anledning til såkaldte polyelektrolytiske komplekser, er kendt fra fysikken og polymerkemien, er de strukturelle og dynamiske egenskaber af sådanne komplekser forblevet uklare.
Gennem de seneste 10-20 år har opdagelsen af funktionelle proteiner uden form, de såkaldte nativt ufoldede proteiner (på engelsk intrinsically disordered proteins, IDPs), ført til et ændret syn på molekylær kommunikation. For eksempel har man set, at antistoffer kan genkende og binde til ustrukturerede regioner, men forskerne har altid antaget, at mindst ét af molekylerne i et givent kompleks, har haft en veldefineret struktur.
- ’Kernemagnetisk resonans spektroskopi, som er et af ekspertiserne i forskningsgruppen SBiNLab på Biologisk Institut, Københavns Universitet, er specielt velegnet til at studere de strukturelle egenskaber af ufoldede proteiner, men det er den særlige kombination af denne teknik med enkelt-molekyle fluorescens-spektroskopi og computersimuleringer, der har ført til beskrivelsen af dette første fuldt dynamiske proteinkompleks’ siger postdoc Katrine Bugge fra SBiNLab, som er en af hovedforfatterne på artiklen.
Resultaterne af afkodningen af de nye molekylære principper som forskningsteamet har påbegyndt, kan give store muligheder for fremtidens design af molekyler, som vi kender fra hverdagen – forbrugsvarer som eksempelvis bestanddele i yoghurter og andre mælkeprodukter - og ikke mindst forbedrede medicinske præparater.
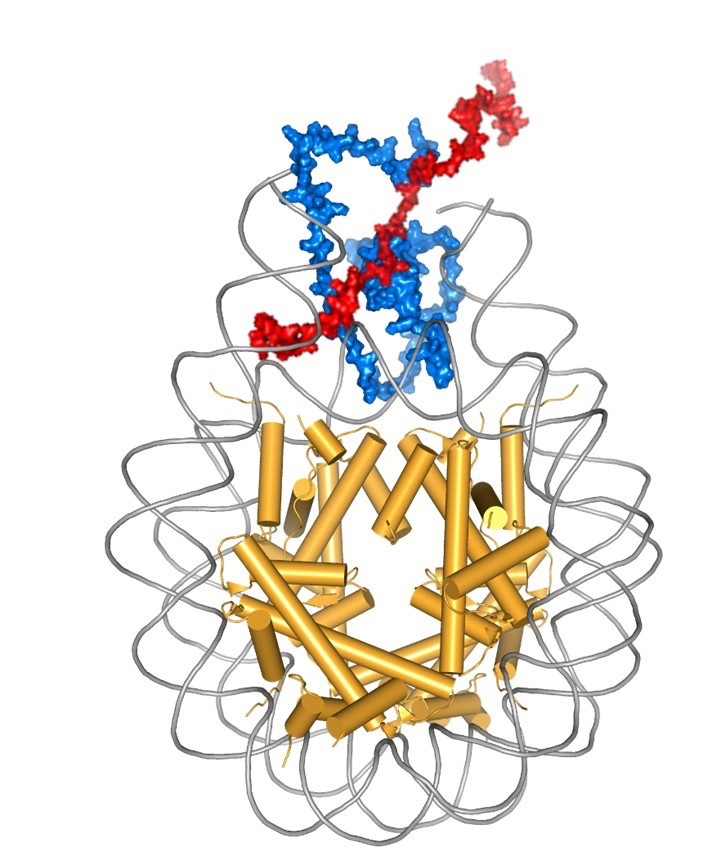
Nukleosom
Læs engelsk pressemeddelelse fra samarbejdspartnerne ved University of Zürich her
Kontakt
Professor Birthe B. Kragelund
SBiNLab, Sektion for Biomolekylære Videnskaber
Biologisk Institut, Københavns Universitet
Mail: bbk@bio.ku.dk
Tlf. +45 2086 0264
Helle Blæsild
Presse & Kommunikation
Biologisk Institut, Københavns Universitet
Mail: kommunikation@bio.ku.dk
Tlf. +45 2875 2076

